
‘파열된 신뢰’ 인공유방...국내 이상사례 4천3백 건
2018년 11월 27일 09시 22분
식품의약품안전처가 암 발병 사례가 보고된 인공유방 보형물이 리콜되고 한 달이 지나서야 동종 제품 사용중지 조치를 내렸으나 역시 유사 발병 사례가 보고된 다른 보형물 제품은 시장 퇴출 대상에서 제외해 그 배경에 의문이 제기된다.
식약처는 한국에서도 미국 엘러간 사가 제조한 거친표면 인공유방 보형물 이식 환자에게 암 발병 사실이 확인되자 뒤늦게나마 동종 제품들을 시장에서 퇴출시킨다는 대책을 내놨다.
그러나 뉴스타파 취재 결과 식약처는 인공유방 시장점유율 2위인 미국 멘토 사 보형물은 퇴출 대상에서 제외한 것으로 확인됐다. 멘토의 보형물이 문제의 암 발생 위험이 있다는 것은 규제당국도 알고 있다.
식약처는 지난 8월 29일 거친 표면 인공유방 보형물이 면역계 암의 일종인 ‘유방보형물 관련 역형성 대세포 림프종’(이하 BIA-ALCL)을 일으킬 가능성이 있다며, 국내 의료기관에 모든 종류의 거친 표면 보형물 사용 중지를 요청했다고 발표했다.
사용 중지 대상인 품목은 ▲폴리텍(수입사 디메드), ▲세빈((주)그린코스코, ▲유로실리콘((주)사이넥스), ▲실리메드(암정메딕스), ▲벨라젤(제조사 한스바이오메드(주)) 이상 5개 사의 6개 ‘거친 표면’(Macro-textured) 인공유방 보형물이다. 림프종 발병 사례가 보고된 엘러간 제품은 이미 리콜돼 사용 중지 대상에 들어 있지는 않다.
식약처는 이번 사용중지 대상에 ‘거친 표면’ 보형물보다 거칠기가 덜한 ‘덜 거친 표면’(Micro-textured) 보형물은 제외했다고 밝혔다. 따라서 미국을 비롯한 전세계 인공유방 보형물 시장에서 엘러간과 함께 시장점유율 1~2위를 다투고 있는 멘토 사의 ‘덜 거친 표면’ 보형물도 퇴출 대상에서 빠졌다.

그러나 지난 2017년 6월 식약처가 실리콘겔 인공유방 제품군 전체를 대상으로 한 의료기기 재평가에서 의료인, 의공학 전문가 그룹인 의료기기위원회는 “멘토 사 및 다른 회사에서 제조된 유방 삽입물을 이식받은 환자에서 BIA-ALCL이 전세계적으로 보고되고 있”으며 “거친(Textured) 표면을 가진 인공유방은 매끄러운(Smooth) 표면의 인공유방 보다 이식 후 BIA-ALCL이 더 빈번하게 발생한다는 보고가 있"다는 문구를 추가하기로 의결한 바 있다.

이 내용은 이번에 식약처 사용중지 대상에서 뺀 ‘덜 거친 표면’ 제품의 사용 시 주의사항에도 동일하게 기재돼 있다. 이처럼 식약처는 ‘덜 거친 표면’ 제품에서도 발병 사례가 있다는 것을 알았지만 어찌 된 영문인지 사용중지 대상에서 제외했다.
멘토 사는 거대 글로벌 기업인 존슨앤드존슨의 자회사다. 한국존슨앤드존슨메디칼은 멘토 사의 인공유방 보형물 국내 수입 및 판매를 맡고 있다.
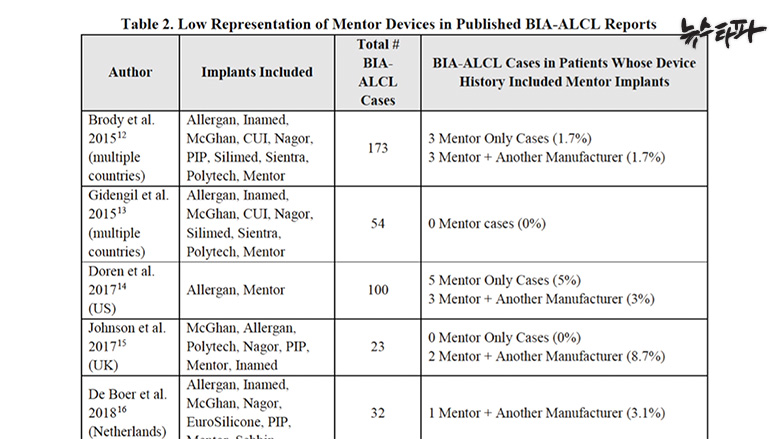
해외 규제 당국은 지금까지 BIA-ALCL이 주로 엘러간 사의 바이오셀(Biocell) ‘거친 표면’ 보형물과 멘토 사의 실텍스(Siltex) ‘덜 거친 표면’ 보형물에서 모두 발생한다는 점에 주목하고 있다.
미국 식품의약국(FDA)이 공식적으로 확인한 인공유방 관련 림프종 환자는 573명이다. 이중 엘러간 보형물을 이식 받은 환자가 481명으로 가장 많고, 멘토 제품 이식 환자가 38명으로 그 뒤를 이었다. 이 림프종으로 사망한 환자 33명 가운데 13명이 지난 7월 리콜된 엘러간(12명), 그리고 멘토(1명) 제품을 이식받은 것으로 확인됐다.
호주 식품의약청(TGA)도 지난 6월 엘러간이 리콜을 결정하기 전에 이미 이 회사 제품을 포함한 거친 표면 유방 보형물 25종의 판매 중지 검토에 나섰다. 여기엔 멘토의 실텍스의 덜 거친 표면 보형물 제품군도 포함돼 있었다.
캐나다 보건국(Health Canada)은 지난 5월 엘러간 바이오셀 거친 표면 보형물에 대한 허가 중지 조치를 알리며 엘러간과 멘토 제품의 BIA-ALCL 발병률을 공개했다.
미국 FDA는 지난 3월 멘토 사가 실텍스 덜 거친 표면 인공유방 보형물 허가를 받은 뒤 의무적으로 진행하는 추적연구를 부실하게 진행하고 있다며 시정을 요구했다. FDA는 멘토가 이 연구에 필요한 이식환자 숫자를 충족하지 못했고, 추적연구에 중요한 영향을 미치는 환자의 소재지, 인종 정보를 빠뜨리는 등 데이터에 중대한 일관성 결여가 발견됐다고 지적했다.
한편, 멘토 사 스스로도 자사 제품의 BIA-ALCL 발병률을 추적하고 보건당국에 꾸준히 보고하고 있다. 멘토 사는 지난 3월 FDA 일반성형의료기기패널위원회 회의에서 자사의 실텍스 제품을 이식받은 환자들의 BIA-ALCL 발병률 연구 결과를 보고했다.
뉴스타파 취재진이 성형외과의 인공유방 보형물 시술 실태를 살펴본 결과, 식약처가 사용 중지 대상에 올리지 않은 멘토 사의 거친 표면 보형물을 오히려 병원 측에서 부작용이 우려된다며 자발적으로 사용하지 않는 아이러니한 상황이 벌어지고 있었다.
멘토 텍스처도 있었는데 텍스처 자체를 요즘 안 쓰는 분위기니까 이제 스무스로 쓰시는 거죠. 멘토 (제품)는 스무스밖에 없어요.
일부 병원은 거친 표면 보형물 뿐 아니라 거칠기가 덜한 마이크로텍스처 보형물도 암 발생 우려가 있다며 대신 스무스 보형물을 권했다.
조금의 찝찝함도 싫으시면 마텍(마이크로텍스처) 하지 마시고요. 스무스 하시고요. 스무스는 제일 오래됐기 때문에 이거 하고 나서 암이 생겼다는 케이스는 없고요.
의료기기 규제감독 기관인 식약처는 사용중지 대상에 넣지 않았는데, 병원이 위험성이 있는 제품을 알아서 사용하지 않는 상황을 식약처는 어떻게 받아들일까?
| 취재 | 김지윤 홍우람 |
| 촬영 | 김기철 신영철 |
| 편집 | 정지성 |
| CG | 정동우 |
뉴스타파는 권력과 자본의 간섭을 받지 않고 진실만을 보도하기 위해, 광고나 협찬 없이 오직 후원회원들의 회비로만 제작됩니다. 월 1만원 후원으로 더 나은 세상을 만들어주세요.