
한스바이오메드, '유해 물질'로 인공유방...경찰 수사
2020년 11월 03일 17시 37분
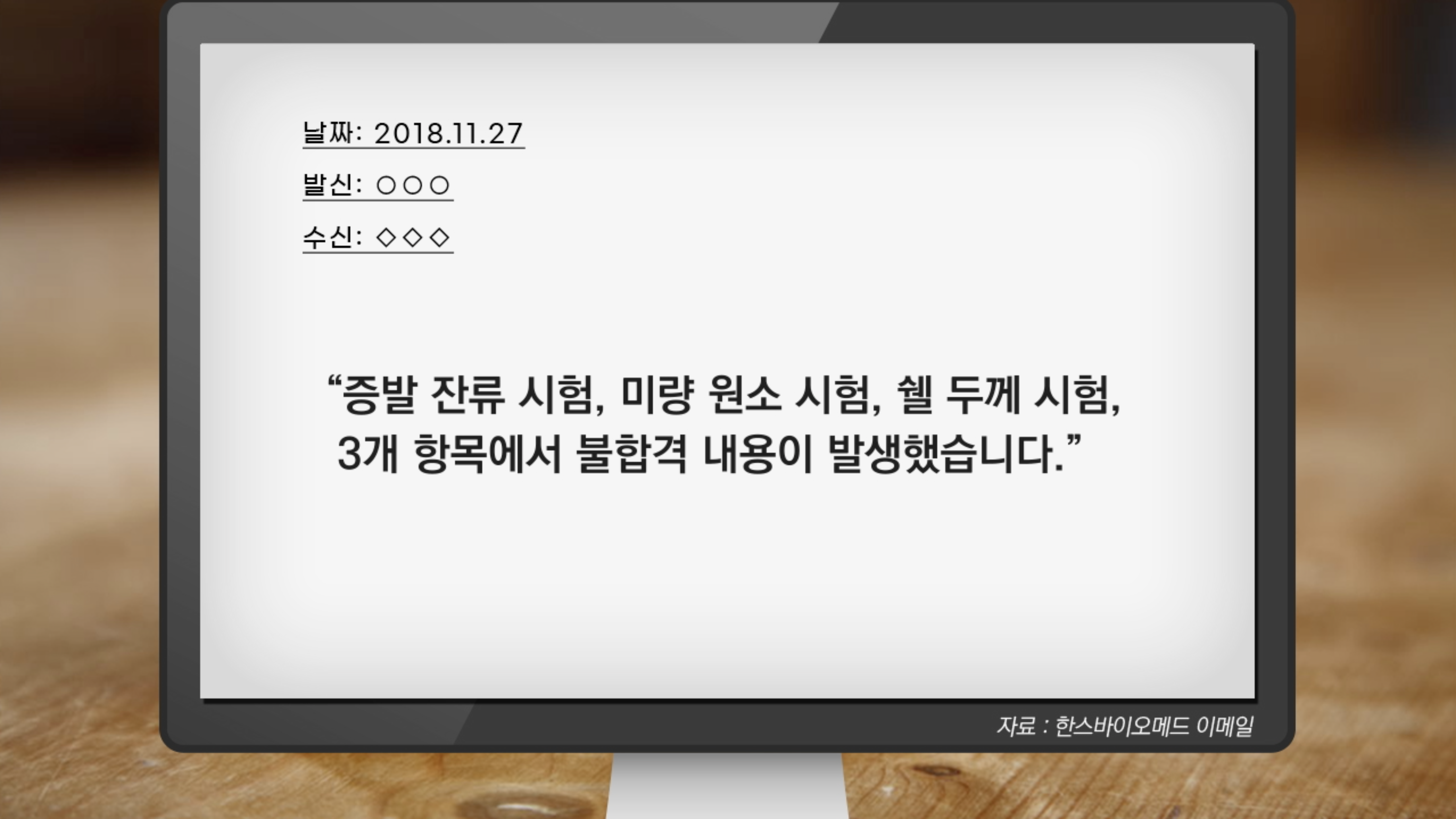

이번 아나토미칼, 마이크로 형명 추가 시에도, 증발 잔류량 시험 pass(통과)를 위하여 shell(쉘) 제조 후, 증발 잔류량이 덜 나오도록 전처리(끓여서 세척)한 샘플로 현지시험 pass하였습니다.--2018년 12월, 한스바이오메드 이메일
| 취재 | 홍우람 |
| 촬영 | 정형민 김기철 오준식 |
| 편집 | 박서영 |
| CG | 정동우 |
| 디자인 | 이도현 |
| 웹출판 | 허현재 |
뉴스타파는 권력과 자본의 간섭을 받지 않고 진실만을 보도하기 위해, 광고나 협찬 없이 오직 후원회원들의 회비로만 제작됩니다. 월 1만원 후원으로 더 나은 세상을 만들어주세요.